Семінар TAIEX. День другий. Обмін досвідом для впровадження європейських стандартів

У Держлікслужбі успішно проведено дводенний семінар з питань ліцензування та сертифікації дистриб’юторів на відповідність вимогам GDP і вимог та правил належного транспортування і зберігання лікарських засобів, організований в рамках інструменту інституціональної розбудови ЄС TAIEX.
Протягом 27-28 листопада 2024 року представники Держлікслужби, її територіальних органів та підприємств поглибили свої знання щодо законодавства ЄС стосовно ліцензування та сертифікації дистриб’юторів на відповідність вимогам GDP та GМP та ознайомились з досвідом держав-членів ЄС щодо сучасних підходів та чинних міжнародних норм і правил при транспортуванні та зберіганні лікарських засобів.
Представник Італійського агентства з лікарських засобів (AIFA) др. Лоренцо Монтрасіо (Dr. Lorenzo Montrasio) та директор Агентства державного контролю при Міністерстві охорони здоров’я Литви др. Гітіс Андруліоніс (Dr. Gytis Andrulionis) ознайомили учасників із загальними положеннями законодавства ЄС щодо ліцензування та сертифікації дистриб’юторів на відповідність вимогам GDP. Керівниця відділу Агентства з лікарських засобів та медичних виробів Хорватії (HALMED) пані Сюзана Остарчевич (Ms Suzana Oštarčević) презентувала досвід контролю та зберіганням і транспортуванням ЛЗ тощо.
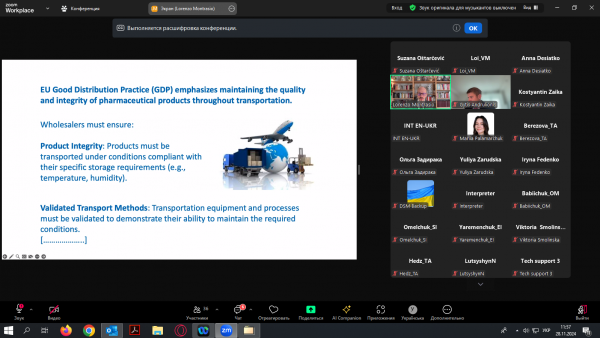
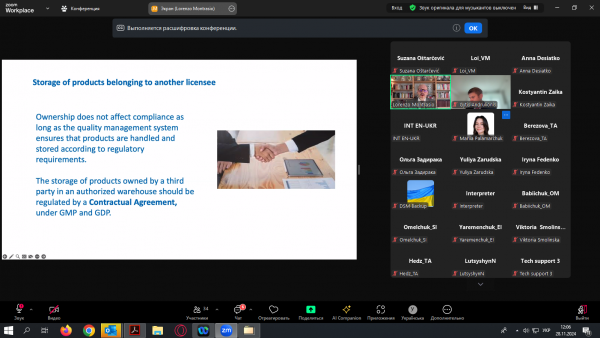
У ході роботи заходу слухачі отримали детальну інформацію щодо порядку видачі ліцензії на провадження діяльності з оптової торгівлі лікарськими засобами; вимог до ліцензіата при здійсненні діяльності з оптової торгівлі в країнах ЄС; порядку здійснення контролю за дотриманням ліцензійних умов, планові та позачергові перевірки, системи якості, контролю ціноутворення на оптовому фармацевтичному ринку; вимог до складських приміщень, площ аптечних складів, гігієни персоналу; вимог до транспортних засобів; підходу до інспекційної оцінки температурних відхилень для продуктів холодового ланцюга тощо.
Семінар TAIEX не лише посилив спроможність учасників щодо питань розробки та подальшого впровадження нормативно-правових актів і стандартів ЄС у фармацевтичну сферу, більш повного забезпечення відповідності національного законодавства щодо якості лікарських засобів та медичних виробів вимогам ЄС, але й створив платформу для обміну досвідом, встановлення нових зв’язків та партнерства Держлікслужби з представниками регуляторних органів країн-членів ЄС.
Реалізація проєктів Європейського Союзу в рамках інструменту ТАІЕХ є важливою запорукою ефективного впровадження реформ в Україні відповідно до положень Угоди про асоціацію між Україною та ЄС і виступає ефективною платформою для обміну кращими практиками впровадження та використання інструментів інституціональної розбудови в країнах Європейського інструменту сусідства.